怎样制取纯净的氢氧化亚铁?详细制取方法大揭秘
在化学实验中,制取氢氧化亚铁并让其长时间保持白色沉淀状态充满了挑战与技巧,这是个很有趣又需要细致对待的问题。
氧气的影响
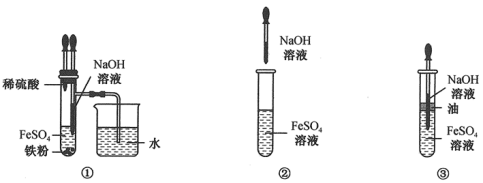
在制取氢氧化亚铁沉淀时,氧气是个大麻烦。空气中的氧气容易与亚铁离子反应,使刚生成的氢氧化亚铁很快被氧化成氢氧化铁。比如在普通实验环境下,溶液一旦接触空气,氧化反应即刻发生。氢氧化亚铁为白色,氢氧化铁为红褐色,氧化后颜色的变化非常明显。而要避免这种情况,就必须有效减少溶液中的含氧量。可以通过多种方式达到这个目的,例如在实验中采用一些操作减少溶液和空气的接触,像在盛FeSO4溶液的试管上加个“保护盖”,用油脂或者苯这类密度比水小的有机物来隔绝空气。
高铁离子的处理
高铁离子Fe3+的存在会干扰氢氧化亚铁沉淀为白色这一现象。在溶液中,如果有Fe3+,制取的沉淀就难以保持理想状态。要除去Fe3+且不引入新杂质很关键。一般来说,选用还原铁粉就能很好地解决这个问题。还原铁粉能将高铁离子还原成亚铁离子,这样就能确保在制取氢氧化亚铁的过程中不受Fe3+的干扰。溶液中的杂质越少,制取白色氢氧化亚铁沉淀的成功率就越高。
新制硫酸亚铁与NaOH反应制取

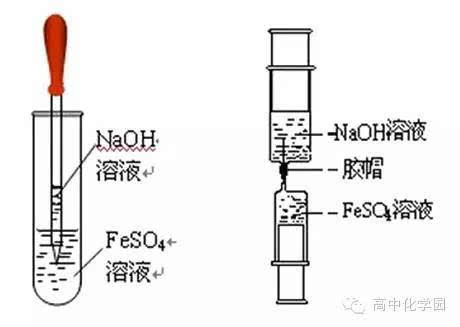
新制的硫酸亚铁和NaOH溶液的反应是制取Fe(OH)2沉淀的常用方法。实验操作需要注意不少细节。像NaOH溶液最好是经过煮沸处理的,这是为了赶跑其中的氧气,然后用特制长滴管深入FeSO4溶液下层滴加。也可以直接加2 - 3粒NaOH固体。在操作过程中,轻轻振荡试管,同时不要破坏油膜。这一系列操作都是为了防止氧气进入溶液影响沉淀颜色。
特殊装置中的制取
利用特殊装置来制取氢氧化亚铁也有独特之处。首先将装置固定好,试管II中加入煮沸过的NaOH溶液并没过导管口。试管I中加入铁粉和稀硫酸溶液并没过导管口。打开止水夹,氢气产生后进入试管II。验纯氢气若合格就关闭止水夹,使得试管I中的硫酸亚铁进入试管II。在整个过程中,通过氢气来排除空气,并制造了一个封闭体系。这种做法避免了亚铁盐的氧化,能得到纯净的氢氧化亚铁沉淀,并且沉淀可以保存较长时间。
实验优化与改进
在另一种制取氢氧化亚铁的实验中,首先加入稀硫酸让铁粉充分反应。等铁粉沉淀后加入煤油。后续又采用了钠和铜片与硫酸亚铁溶液反应的方法。这里面的加入煤油起到的仍然是隔绝空气的作用。而用钠和铜片反应则可能在反应活性等方面进行了优化。这个方法制得的氢氧化亚铁絮状沉淀能保持长达一个星期,是非常有效的实验改进。
实验意义
这种制取氢氧化亚铁沉淀并使其长时间保持白色的实验,在化学教学和研究中有重要意义。从教学角度来看,学生可以通过清晰的实验现象,更好地理解亚铁离子、铁离子之间的转化,以及氧气对化学反应的影响等化学原理。在研究领域,有助于探索更高效的防氧化技术和更精准的化学反应条件控制。而且这些实验方法的改进提高了实验的准确性和可重复性。这些实验到底能给我们在其他相关化学实验或者工业生产中带来什么样更多的启发?





